MP Board 12th Chemistry Trimasik Exam 2023-24 : एमपी बोर्ड 12वीं रसायन विज्ञान पेपर त्रैमासिक महत्वपूर्ण प्रश्न (VVI Most Important Question)

SHARING IS CARING
If our Website helped you a little, then kindly spread our voice using Social Networks. Spread our word to your readers, friends, teachers, students & all those close ones who deserve to know what you know now.
MP Board 12th Chemistry Trimasik Exam 2023-24 : एमपी बोर्ड 12वीं रसायन विज्ञान पेपर त्रैमासिक महत्वपूर्ण प्रश्न (VVI Most Important Question)
एमपी बोर्ड कक्षा 12वीं रसायन विज्ञान त्रैमासिक पेपर की तैयारी के लिए हम आपको MPBSE 12th Chemistry Trimasik Paper 2023 Most Important Questions इस लेख के माध्यम से बता रहें हैं, जो आपके Paper के लिए बहुत महत्वपूर्ण है और ये Most Important Question तैयारी को और बेहतर बना सकते है I
जिनसे 16/09/2023 को होने वाला एमपी बोर्ड 12th रसायन विज्ञान त्रैमासिक एक्जाम क्वेश्चन पेपर 2023 बनाया जाएगा। जिससे वे त्रैमासिक परीक्षा के रसायन विज्ञान के पेपर में अच्छे अंकों से पास हो सकें।
2 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : मोलरता एवं मोललता को इकाई सहित परिभाषित कीजिए।
उत्तर : 1. मोलरता- "किसी विलयन की मोलरता उसके एक लीटर में घुले |विलीन हुए| विलय पदार्थ के मोलों की संख्या है।" इसे M द्वारा दर्शाती है।

प्रश्न 2 : हेनरी के नियम को उदाहरण सहित समझाइए |
Or
हेनरी नियम को लिखते हुए कुछ प्रमुख अनुप्रयोग भी लिखिए।
हल
हेनरी का नियम-स्थिर ताप पर किसी विलायक के निश्चित आयतन में विलेय गैस का द्रव्यमान गैस के दाब के समानुपाती होता है, जिसके साथ वह विलायक साम्यावस्था में है।
यदि विलायक आयतन में विलेय गैस का द्रव्यमान m तथा साम्य दाब हो, तो
m = kp (जहाँ k एक स्थिरांक है।)
उदाहरण (Applications of Henry’s law) – गहरे समुद्र में गोताखोरी के लिए- गहरे समुद्र में गोताखोरी करते समय श्वसन के लिए संपीडित वायु का उपयोग किया जाता है। संपीडित वायु में O2 के अतिरिक्त N2 भी होती है जो सामान्य दाब पर रक्त में ज्यादा विलेयशील नहीं होती है किन्तु उच्च दाब पर N2 की रक्त में विलेयता बढ़ जाती है एवं N2 रक्त में घुल जाती है। रक्त में नाइट्रोजन की उच्च सान्द्रता के हानिकारक प्रभावों एवं बेण्ड्स को रोकने के लिए गोताखोरों द्वारा प्रयुक्त टैंक को हीलियम द्वारा तनु किए गए वायु (He = 11.7%, N2 = 56-2% एवं O2 = 32.9%) से भरते हैं।
प्रश्न 3 :120 ग्राम NaoH को 2 लीटर विलयन में विलेय किया गया है तो विलयन की मोलरता ज्ञात कीजिए?
उत्तर :

प्रश्न 4: मोल प्रभाज किसे कहते है ?
उत्तर : विलयन में किसी घटक के मोलो की संख्या तथा विलयन में उपस्थित कुल मोलो की संख्या के अनुपात को उस घटक के मोल अंश या मोल भिन्न या मोल प्रभाज कहते है। इसे X द्वारा प्रदर्शित किया जाता है।
माना किसी मिश्रण में एक पदार्थ के मोल A है तथा इस मिश्रण में कुल मोल T है तो परिभाषा के अनुसार मोल अंश को निम्न प्रकार प्रदर्शित किया जाता है – X = A/T
कभी कभी मिश्रण या विलयन के कुल मोल ज्ञात करने के लिए सभी अलग अलग पदार्थों के मोल का योग किया जाता है जिससे मिलकर वह मिश्रण बना हुआ है।
विलेय का मोल अंश = विलेय के मोल/विलयन का कुल मोल
विलायक का मोल अंश = विलायक के मोल/विलयन के कुल मोल
यहाँ याद रखे की विलयन के कुल मोल का मान विलेय तथा विलायक के मोलों का योग करके प्राप्त होती है।
विलेय के मोल अंश + विलायक के मोल अंश = 1
किसी विलयन का मिश्रण में उपस्थित सभी पदार्थों के मोल अंश का योग का मान 1 के बराबर होता है।
प्रश्न 5 : ओम का नियम लिखिए |
उत्तर : ओम का नियम- यदि किसी चालक की भौतिक अवस्था (जैसे-लम्बाई, ताप आदि) में परिवर्तन न हो तो उसमें प्रवाहित होने वाली विद्युत् धारा उसके सिरों पर लगाये गये विभवान्तर के अनुक्रमानुपाती होती है।
यदि चालक के सिरों पर लगाया गया विभवान्तर V और उसमें बहने वाली धारा I हो, तो
V ∝ I या V = R.I
यहाँ R एक नियतांक है, जिसे उस चालक का प्रतिरोध कहते हैं।
प्रश्न 6 : DNA व RNA में अंतर लिखिए |
उत्तर :
| DNA | RNA |
| डीएनए का फुलफॉर्म डी ऑक्सीराइबोन्यूक्लिक एसिड होता है | RNA का फुलफॉर्म राइबोन्यूक्लिक एसिड है | |
| इसमें डी-ऑक्सिराइबोज शर्करा पाई जाती है। | इसमें राइबोज शर्करा पाई जाती है। |
| डीएनए कोशिका के केन्द्रक में तथा कुछ अन्य सेल ऑर्गेनाल्स में और पौधों की माइटोकॉण्ड्रिआ में पाया जाता है | आरएनए कोशिका के कोशिका द्रव्य में पाया जाता है। यह कोशिका के नाभिक में बहुत कम पाया जाता है। |
3 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : आदर्श व अनादर्श विलयन में अंतर लिखिए।
उत्तर :
निश्चित संघटन वाला ऐसा द्रव मिश्रण जो एक निश्चित ताप पर उबलता है और बिना संघटन बदले उसी ताप पर आसवित होता है, स्थिरक्वाथी विलयन कहलाता है।
उदाहरण- एथिल एल्कोहल में जल और अनुपात में स्थिरक्वाथी मिश्रण बनाते हैं।
| आदर्श विलयन | अनादर्श विलयन |
| (1) जो विलयन राउल्ट के नियम का पूर्ण पालन करता हैं। उसे आदर्श विलयन कहते हैं। | ये विलयन राउल्ट के नियम का पूर्ण पालन नहीं करते हैं। |
| (2) ये वास्तविक विलयन नहीं होते हैं। | ये वास्तविक विलयन होते हैं। |
| (3) ये धनात्मकता तथा ॠणात्मकता नहीं दर्शाते । | ये धनात्मकता तथा ऋणात्मकता दर्शाते हैं। |
| (4) उदाहरण - बेन्जीन + टालुईन | उदाहरण- H2O+CH3OH और H2O+HCL |
प्रश्न 2 : निम्न को समझाइये -
1) फॉर्मलता
2) नार्मलता
3) पार्टस पर मिलियन
उत्तर :
(i) फॉर्मलता - किसी विलयन के एक लीटर में घुले हुए विलेय के ग्राम सूत्र द्रव्यमानों की संख्या को विलयन की फॉर्मलता कहते है। इसे F द्वारा प्रदर्शित करते है

(ii) नॉर्मलता (Normality) - "किसी विलयन की नॉर्मलता उसके एक लीटर विलयन में उपस्थित विलेय के ग्राम तुल्यांकों की संख्या है।" इसे N द्वारा दर्शाते हैं। यदि किसी विलयन के एक लीटर में विलेय पदार्थ का एक ग्राम-तुल्यांक विलेय हो तो उस विलयन की नॉर्मलता 1 N होगी। उसी प्रकार यदि किसी विलयन के 1 लीटर में 0.5 ग्राम तुल्यांक विलेय पदार्थ विलेय हो, तो उसकी नॉर्मलता 0.5 N होगी।

(iii) पार्ट्स प्रति मिलियन (Parts Per million) या ppm - यह इकाई तब उपयोग में लायी जाती है, जब विलयन ड में विलय का सान्द्रण बहुत कम हो। अंश या भाग (Parts) आयतन अथवा द्रव्यमान के रूप में हो सकते हैं। उदाहरणार्थ- यदि 1 kg समुद्री जल में विलेय ऑक्सीजन का द्रव्यमान 5.8×10-3 ग्राम हो, तो उसे इस प्रकार दर्शाया जायेगा कि 106 ग्राम (या एक मिलियन ग्राम) समुद्री जल में 5.8 ग्राम का ऑक्सीजन है। अत: समुद्री जल में ऑक्सीजन का सान्द्रण 5.8 ppm है।

प्रश्न 3: SN 1 और SN 2 अभिक्रियाओं की क्रियाविधि समझाइये तथा इनमें अन्तर भी स्पष्ट कीजिए।
उत्तर :
जब किसी यौगिक ने उपस्थित परमाणु या नाभिक स्नेही को अपेक्षाकृत प्रबल नाभिक स्नेही द्वारा प्रतिस्थापित कर दिया जाता है तो इसे नाभिक स्नेही प्रतिस्थापन अभिक्रिया कहते हैं। जैसे - एल्किल हैलाइड को जलीय KoH द्वारा जल अपघटन कराने पर एल्कोहल प्राप्त होता है।
SN1 अभिक्रिया - यह क्रिया दो पदों में संपन्न होती है। इनका वेग केवल क्रिया- कारक की सांद्रता पर निर्भर करता है। विभिन्न हैलाइडों के लिए SN1 अभिक्रिया की क्रियाशीलता का क्रम निम्न है -
3°>2°>1°>CH3 X । इनका वेग ध्रुवीय विलायकों में बढ़ता है।
SN2 अभिक्रिया - यह क्रिया एक ही पद में संपन्न होती है। इनका वेग क्रिया - कारक और नाभिक स्नेही दोनों की सांद्रता पर निर्भर करता है। विभिन्न एल्किल हैलाइडों के लिए अभिक्रिया की क्रियाशीलता का क्रम निम्न है - CH3 X > 1°>2°>3°। इनका वेग ध्रुवीय विलायकों में घटता है।
SN1 और SN2 अभिक्रिया में अंतर -
| SN1 अभिक्रिया | SN2 अभिक्रिया |
| 1. इनका वेग केवल क्रिया- कारक की सांद्रता पर निर्भर करता है। | इनका वेग क्रिया - कारक और नाभिक स्नेही दोनों की सांद्रता पर निर्भर करता है। |
| 2. यह क्रिया दो पदों में संपन्न होती है। | यह क्रिया एक ही पद में संपन्न होती है। |
| 3. विभिन्न हैलाइडों के लिए SN1 अभिक्रिया की क्रियाशीलता का क्रम निम्न है - 3°>2°>1°>CH3 X | विभिन्न एल्किल हैलाइडों के लिए अभिक्रिया की क्रियाशीलता का क्रम निम्न है - CH3 X > 1°>2°>3° |
| 4. इनका वेग ध्रुवीय विलायकों में बढ़ता है। | इनका वेग ध्रुवीय विलायकों में घटता है। |
| 5. आयनिक होने के कारण ही है तीव्र गति से संपन्न होती है। | यह अपेक्षाकृत धीमी गति से संपन्न होती है। |
| 6. इनमें कार्बोनियम आयन बनने के कारण पुनः व्यवस्थित उत्पाद प्राप्त होता है। | पुनः व्यवस्थित उत्पाद प्राप्त नहीं होता है। |
प्रश्न 4 : लैन्थेनाइट संकुचन के क्या कारण है |
उत्तर- लैन्थेनाइड संकुचन-
लैन्थेनाइडों के परमाणु क्रमांक बढ़ने के साथ-साथ उनके परमाणुओं एवं आयनों के आकार में कमी होती है, इसे लैन्थेनाइड संकुचन कहते हैं।
कारण- लैन्थेनाइडों में आने वाला नया इलेक्ट्रॉन बाह्यतम कक्ष में न जाकर (1-2)/- उपकोश में प्रवेश करता है, फलतः इलेक्ट्रॉन और नाभिक के मध्य आकर्षण बल में वृद्धि होती है, जिससे परमाणु अथवा आयन संकुचित हो जाता है।
लैन्थेनाइड संकुचन का प्रभाव -
(i) लैन्थेनाइडों के गुणों में परिवर्तन- लैन्थेनाइड संकुचन के कारण इनके रासायनिक गुणों में बहुत कम परिवर्तन होता है। अतः इन्हें शुद्ध अवस्था में प्राप्त करना अत्यन्त कठिन होता है।
(ii) अन्य तत्वों के गुणों पर प्रभाव- लैन्थेनाइड संकुचन का लैन्थेनाइडों से पूर्व आने वाले तथा इनके बाद आने वाले तत्वों के आपेक्षिक गुणों पर बहुत महत्वपूर्ण प्रभाव पड़ता है। उदाहरण के लिए, Ti और Zr के गुणों में भिन्नता होती है, जबकि Zr और Hf गुणों में काफी समानता रखते हैं।
प्रश्न 5 : लैन्थेनाइट एवं ऐक्टिनाइडस में अंतर लिखिए |
उत्तर :
| लैन्थैनाईड | एक्टिनाईड |
| विभेदीकरण या अंतिम इलेक्ट्रॉन (n-2) कक्षा के 4f-उपकोश में प्रवेश करता है। | विभेदीकरण या अंतिम इलेक्ट्रॉन (n-2) कक्षा के 5f-उपकोश में प्रवेश करता है। |
| ये तत्व लैंथेनम के बाद आते हैं, इसलिए लैंथेनाइड कहलाते हैं। | ये तत्व एक्टिनियम के बाद आते हैं, इसलिए एक्टिनाईड कहलाते हैं। |
| इनकी सामान्य ऑक्सीकरण अवस्था +3 है। ये +2 एवं +4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करते हैं। | एक्टिनाइडों में भी सामान्य ऑक्सीकरण अवस्था +3 है किन्तु ये अन्य उच्चतर ऑक्सीकरण अवस्थाएँ जैसे- +4, +5, +6, +7 भी प्रदर्शित करते हैं। |
| परमाणु या आयनिक त्रिज्या क्रमशः घटती है एवं यह लैंथेनाइड संकुचन कहलाती है। | परमाणु या आयनिक त्रिज्या क्रमशः एवं समान रूप से घटती है एवं यह एक्टिनाइड संकुचन कहलाती है |
| लैंथेनाइडों में संकुल बनाने की प्रवृत्ति कम होती हैं। | एक्टिनाइडों में संकुल बनाने की प्रवृत्ति अपेक्षाकृत उच्च होती है। |
| लैंथेनाइड ऑक्सो आयन नहीं बनाते हैं। | ये ऑक्सो आयन जैसे- UO2 ,PuO2 आदि बनाते हैं। |
| लैंथेनाइडों के यौगिक कम क्षारीय प्रकृति प्रदर्शित करते हैं। | एक्टिनाइडों के यौगिक अधिक क्षारीय प्रकृति करते हैं। |
| प्रोमिथियम के अतिरिक्त लैन्थेनाइड रेडियोऐक्टिव नहीं हैं| | सभी एक्टिनाइड रेडियोऐक्टिव हैं। |
| Pm के अतिरिक्त अन्य लैंथेनाइड प्रकृति में आयोडीन की अपेक्षा अधिक उपलब्धता में उपस्थित हैं। | इनमें से अधिकांश प्रकृति में नहीं पाये जाते हैं एवं कृत्रिम रूप से बनाये जाते हैं। |
4 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : निम्न अभिक्रियाओं को समझाइये |
अ) सेण्डमेयर अभिक्रिया ब) हुन्सडीकर अभिक्रिया स) वुड्स-फिटींग अभिक्रिया द) फ्रीडल क्राफ्ट अभिक्रिया
उत्तर :
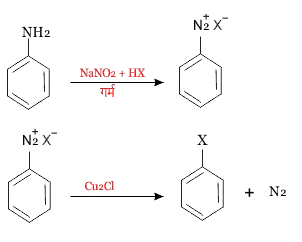
अ) सेण्डमेयर अभिक्रिया - वह अभिक्रिया जिसमे प्राथमिक ऐमीन को सोडियम नाइट्राइल (NaNO2) के साथ के लिए क्रिया कराने पर डाइ ऐजोनियम लवण बनते हैं। इसकी क्यूप्रस क्लोराइड (Cu2Cl) अथवा क्यूप्रस ब्रोमाइड (Cu2Br) के साथ क्रिया कराने पर डाइ एजोनियम समूह–Cl अथवा –Br के द्वारा प्रतिस्थापित हो जाते हैं। इस अभिक्रिया को सैण्डमेयर अभिक्रिया (sandmeyer reaction in Hindi) कहते हैं।
ब) हुन्सडीकर अभिक्रिया - हुन्सडीकर विधि-ऐरोमैटिक कार्बोक्सिलिक अम्ल के सिल्वर लवण को ब्रोमीन के साथ गर्म करने से ऐरिल ब्रोमाइड बनता है।
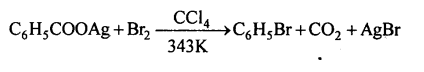
स) वुड्स-फिटींग अभिक्रिया - वह अभिक्रिया जिसमे हैलोएल्केन के दो अणु सोडियम धातु के साथ शुष्क ईथर की उपस्थिति में क्रिया करते हैं तो सममित एल्केन प्राप्त होते हैं। इस अभिक्रिया को वर्ट्ज अभिक्रिया (wurtz reaction in Hindi) कहते हैं।

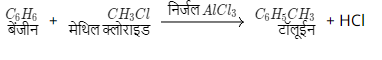
द) फ्रीडल क्राफ्ट अभिक्रिया - वह अभिक्रिया जिसमे एनिसोल की एल्किल या ऐसिल हैलाइड के साथ निर्जल (AlCl3) की उपस्थिति में क्रिया कराते हैं। तो एल्किल अथवा ऐसिल समूह ऑर्थो तथा पैरा स्थितियों में प्राप्त होते हैं इस फ्रिडेल क्राफ्ट अभिक्रिया (friedel craft reaction in Hindi) कहते हैं।
MP Board Class 12 Study Material
| MP Board Class 12 Study Material | |
| MP Board Class 12 Books | MP Board Class 12 Syllabus |
| MP Board Class 12 Model Paper | MP Board Class 12 Previous Year Question Paper |
प्रश्न 2 : विलोपन अभिक्रिया किसे कहते है | इससे सम्बधिंत सेटजेफ का नियम लिखिए |

5 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : विशिष्ट चालकता, तुल्यांकी चालकता एवं आण्विक चालकता का सूत्र एवं इकाई लिखिए तथा इन पर तनुता का प्रभाव स्पष्ट कीजिए।
उत्तर : किसी विद्युत अपघट्य के विलयन की प्रतिरोधकता का व्युत्क्रम-उसकी विशिष्ट चालकता होती है। किसी विलयन की विशिष्ट चालकता उसके एक घन सेमी विलयन की चालकता होती है। विशिष्ट चालकता की k(Kappa) से दर्शाते है।
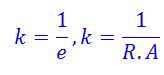
इसकी इकाई Ω-1m-2 होती है।
तनुता का प्रभाव:- किसी विलयन की तनुता में वृद्धि अथवा सांद्रण में किसी से उसकी विशिष्ट चालकता का मान कम हो जाता है। ऐसा इसलिए होता है, क्योंकि तनुता में वृद्धि से ‘एक घन सेमी’ विलयन में उपस्थित आयनों की संख्या कम हो जाती है।
तुल्यांकी चालकता:-
पहली परिभाषा:- किसी विलयन की तुल्यांकी चालकता उन समस्त आयनों की चालकता है, जो एक ग्राम- तुल्यांक विद्युत-अपघट्य को Vml में विलेय करने से उत्पन्न होती है। इसे संकेत λaq (लेम्बडा) से लिखा जाता है।
दूसरी परिभाषा:- किसी विद्युत-अपघट्य के विलयन की l तुल्यांक चालकता या तुल्यांकी चालकता उसकी विशिष्ट चालकता तथा आयतन V का गुणनफल है, जहाँ V ml में विलयन का वह आयतन है, जिसमें विद्युत-अपघट्य का एक ग्राम-तुल्यांक विलेय हो।
इकाई- तुल्यांकी चालकता की इकाई आम-1 सेमी2 तुल्यांक-1 है।
अर्थात् λaq = k×V
तनुता का प्रभाव:- तुल्यांकी चालकता, विशिष्ट चालकता तथा घन सेमी में आयतन के गुणनफल के बराबर होती है। तनुता में वृद्धि से विशिष्ट चालकता का मान कम होता है तथा V के मान में वृद्धि होती है। विशिष्ट चालकता के मान में वृद्धि होती है।
आण्विक चालकता की परिभाषा:- पहली परिभाषा:- किसी विलयन की आण्विक चालकता उन समस्त आयनों की चालकता है जो एक ग्राम मोल विद्युत
प्रश्न 2 : मानक हाइड्रोजन इलेक्ट्रोड क्या है? यह कैसे बनाया जाता है? इसकी दो सीमाएं लिखिए |
उत्तर : एकल इलेक्ट्रोड के इलेक्ट्रोड विभव का परम मान ज्ञात नहीं किया जा सकता है, क्योंकि ऑक्सीकरण अर्द्ध अभिक्रिया या अपचयन अर्द्ध अभिक्रिया अकेले सम्पन्न नहीं हो सकती है।
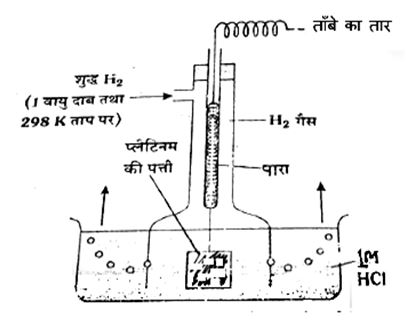
इसका निर्धारण तभी सम्भव है, जब कुछ इलेक्ट्रोडों का प्रयोग संदर्भ इलेक्ट्रोड (reference electrode) के रूप में किया जाए। अतः इलेक्ट्रोड विभव के मापन में मानक हाइड्रोजन इलेक्ट्रोड (SHE या NHE) का उपयोग संदर्भ इलेक्ट्रोड के रूप में किया जाता है।
यह प्लैटिनीकृत प्लैटिनम (Platinised Platinum) इलेक्ट्रोड का बना होता है। इसके लिए प्लैटिनम की एक पतली पत्तर (Foil) को क्लोरोप्नैटिनिक अम्ल में रखकर प्रत्यक्ष विद्युत धारा (D.C.) प्रवाहित कर उसकी सतह पर प्लैटिनम-ब्लैक की एक पतली तह जमा दो जाती है। इस प्लैटिनम की पत्ती का संबंध एक काँच की नली में रखे पारे से रहता है, जिसे चित्र में दिखाया गया है। पारे में तांबे का एक तार लटकता रहता है। यह इलेक्ट्रोड एक वायुमण्डलीय दाब पर शुद्ध H2 गैस से पहले से ही संतृप्त इकाई (1 MH+) आयन सान्द्रण वाले HCI विलयन में डूबा रहता है। जब 1 वायु दाब एवं 298 K ताप पर शुद्ध H2 गैस को प्लैटिनम ब्लैक इलेक्ट्रोड पर बुलबुलों के रूप में प्रवेश कराया जाता है। अतः मानक हाइड्रोजन इलेक्ट्रोड पर ऑक्सीकरण होता है, इस प्रकार विलयन में निम्नलिखित अभिक्रिया होती है-
H2 → 2H++ 2e—
अर्थात् कुछ हाइड्रोजन (H2) गैस H+ आयन में परिवर्तित होकर विलयन में चले जाते हैं।
जब यह इलेक्ट्रोड कैथोड के रूप में (अर्थात् मानक हाइड्रोजन इलेक्ट्रोड पर अपचयन होता है) व्यवहार करता है, तब निम्न अभिक्रिया होती है-
2H++2e— → H2
अर्थात् विलयन से कुछ H+ आयन H2 गैस में परिवर्तित होते हैं।
अतः इलेक्ट्रोड H+ के सापेक्ष उत्क्रमणीय हो जाता है। इस इलेक्ट्रोड (अर्द्ध सेल) का प्रदर्शन निम्नानुसार किया जाता है-
Pt, H2 (g) | H+ (cone. = c)
298 K पर H2 गैस इलेक्ट्रोड का मानक विभव 0.000 (शून्य) वोल्ट माना जाता है।
प्रश्न 3 :संक्षारण किसे कहते है ? संक्षारण को प्रभावी करने वाले कारक तथा संक्षारण से बचने के उपाय बताइये।
उत्तर : वायुमण्डल में उपस्थित गैसों तथा नमी द्वारा धातुओं के धीमी गति से अवांछित यौगिकों में बदल जाने की प्रक्रिया संक्षारण कहलाती है।
प्रभावित करने वाले कारक— धातुओं का संक्षारण अनेक कारकों पर निर्भर करता है जो निम्न है—
- धातु की क्रियाशीलता—अधिक क्रियाशील धातु के संक्षारण की सम्भावना किसी अन्य कम क्रियाशील धातु की तुलना में अधिक होती है। उदाहरण— लोहा अपने से कम क्रियाशील धातु चाँदी की तुलना में अधिक तेजी से संक्षारित होता है।
- धातु में अशुद्धियों की उपस्थिति—शुद्ध धातुएँ प्रायः अधिक संक्षारित नहीं होती है। एक धातु में अन्य अशुद्ध धातुओं की उपस्थिति उस धातु में संक्षारण को प्रेरित करती है।
- जल में विद्युत अपघट्यों की उपस्थिति—जल में विद्युत अपघट्य पदार्थों की उपस्थिति संक्षारण की दर में वृद्धि करती है।
उदाहरण— लोहे का संक्षारण आसुत जल की तुलना में समुद्री जल में अधिक होता है।
- वायु में क्रियाशील गैसों की उपस्थिति—वायु में उपस्थित क्रियाशील गैसे जैसे— CO2, SO2, NO2 आदि जल में घुलकर अम्लों का निर्माण करती है, जो विद्युत अपघट्यों का कार्य करते है एवं संक्षारण प्रक्रिया को त्वरित करते हैं।
संक्षारण से बचाव के उपाय—
- रोधिका रक्षण—इस रक्षण में लोहे तथा वायुमण्डलीय ऑक्सीजन और नमी के बीच एक रोधिका फिल्म (Barrier film) प्रवेश करायी जाती है। इस रक्षण हेतु निम्नलिखित विधियों प्रयुक्त की जा सकती है—
(i) धातु की सतह पर प्रलेपन द्वारा।
(ii) धातु की सतह पर तेल अथवा ग्रीस को पतली फिल्म की तह चढ़ाकर।
(iii) धातु की सतह पर कुछ संक्षारित न होने वाली धातुओं की परत चढ़ाकर।
- समर्पणी लक्षण—इस विधि में लोहे पर उससे अधिक सक्रिय धातु को तह चढ़ाकर जंग लगने से बचाया जाता है। लोहे की अपेक्षा सक्रिय धातु प्राथमिकता से इलेक्ट्रॉन त्याग देती है, जिससे लोहे पर जंग लगने से रोकी जा सकती है। समय के उचित अन्तराल मे तह लगाने वाली धातु की खपत हो जाती है, परन्तु जब तक यह उपस्थित रहती है, लोहे की लगभग पूरी खुली सतह होने पर भी जंग नहीं लगती। इस प्रकार इस प्रारूप की परत में लगी खरोंच भी हानिकारक नहीं होती। लोहे से अधिक सक्रिय धातु जिक है, जो प्रायः लोहे के समर्पणी रक्षण में काम आती है। लोहे पर जिंक चढ़ाने का प्रक्रम गैल्वेनीकरण (galvanisation) कहलाता है।







 Profile
Profile Signout
Signout












 Quiz
Quiz
 Get latest Exam Updates
Get latest Exam Updates 










