MP Board 11th Chemistry Trimasik Exam 2023-24 : एमपी बोर्ड 11वीं रसायन विज्ञान पेपर त्रैमासिक महत्वपूर्ण प्रश्न (VVI Most Important Question)

SHARING IS CARING
If our Website helped you a little, then kindly spread our voice using Social Networks. Spread our word to your readers, friends, teachers, students & all those close ones who deserve to know what you know now.
MP Board 11th Chemistry Trimasik Exam 2023-24 : एमपी बोर्ड 11वीं रसायन विज्ञान पेपर त्रैमासिक महत्वपूर्ण प्रश्न (VVI Most Important Question)
एमपी बोर्ड कक्षा 11वीं रसायन विज्ञान त्रैमासिक पेपर की तैयारी के लिए हम आपको MPBSE 11th Chemistry Trimasik Paper 2023 Most Important Questions इस लेख के माध्यम से बता रहें हैं, जो आपके Paper के लिए बहुत महत्वपूर्ण है और ये Most Important Question तैयारी को और बेहतर बना सकते है I
जिनसे 16/09/2023 को होने वाला एमपी बोर्ड 11th रसायन विज्ञान त्रैमासिक एक्जाम क्वेश्चन पेपर 2023 बनाया जाएगा। जिससे वे त्रैमासिक परीक्षा के रसायन विज्ञान के पेपर में अच्छे अंकों से पास हो सकें।
2 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : सीमान्त अभिकारक क्या है?
उत्तर: संतुलित समीकरण में जो क्रियाकारक कम मात्रा में उपस्थित रहता है, वह पहले समाप्त हो जाता है। ऐसे क्रियाकारक को सीमांत अभिकर्मक कहते हैं क्योंकि वह उत्पाद की मात्रा को सीमित कर देता है।
प्रश्न 2 : यौगिक के मूलानुपाती सूत्र को परिभाषित कीजिए।
उत्तर: वह सूत्र जो किसी यौगिक के अणु में विद्यमान विभिन्न तत्वों के परमाणुओं के सरल अनुपात को दर्शाता है मूलानुपाती सूत्र (Empirical formula) कहलाता है।
जैसे- ऐसीटिक अम्ल का मूलानुपाती सूत्र = CH2O
ग्लूकोज का मूलानुपाती सूत्र = CH2O
प्रश्न 3 : n+1 नियम उदाहरण के साथ समझाइये।
उत्तर: n+l नियम के अनुसार-“ एक नया इलेक्ट्रॉन उस ऑर्बिटल में पहले प्रवेश करता है जिसके लिये n + l का मान सबसे कम होता है। यदि दो या दो से अधिक ऑर्बिटलों के लिये n + l का मान समान हो, तो नया आने वाला इलेक्ट्रॉन उस ऑर्बिटल में प्रवेश करता है जिसका n का मान न्यूनतम होता है।
उदाहरण: यदि आकाश में बॉल को फेका जाए तो वह अनंत गर्भ में विलीन हो जाएगी, यदि वायु का घर्षण तथा गुरुत्व इसके विरुद्ध नहीं हो. पेड़ को हिलाने से उसके फूल टूटकर नीचे गिर जाते है.
प्रश्न 4 : परमाणु द्रव्यमान की मानक इकाई क्या है?
उत्तर: परमाणु द्रव्यमान की मानक इकाई परमाण्विक भार इकाई या amu है।
Explanation:
- परमाणु के परमाणु द्रव्यमान को एक परमाणु में मौजूद प्रोटॉनों की संख्या और न्यूट्रॉन की संख्या के योग के रूप में दिया जा सकता है।
- यह एक तत्व के सभी समस्थानिकों का औसत परमाणु द्रव्यमान है।
प्रश्न 5 : मोल संकल्पना क्या है?
उत्तर: मोल एक संख्या है जिसका मान 6.022 ×1023 होता है। यह सूक्ष्म कणों, जैसे- परमाणु, अणु, आयन आदि की संख्या को प्रदर्शित करने की एक इकाई है।
प्रश्न 6 : प्रकाश विद्युत प्रभाव क्या हैं?
उत्तर: जब उचित आवृत्ति, तरंगदैर्ध्य या ऊर्जा का प्रकाश कुछ धातुओं पर आपतित होता है, तो उनमें से इलेक्ट्रॉन उत्सर्जित होने लगता है। प्रकाश की इस घटना को प्रकाश विद्युत प्रभाव कहते हैं। इस घटना में प्रकाश ऊर्जा का विद्युत ऊर्जा में रूपांतरण होगा।
प्रश्न 7 : परिरक्षण प्रभाव क्या हैं?
उत्तर: इलेक्ट्रॉनों पर समान ऋण -आवेश होता है तथा ये एक -दूसरे को प्रतिकर्षित करते है और यह प्रतिकर्षण बल नाभिक द्वारा बाहरी कोश पर लग रहे आकर्षण बल को कम कर देता है , जिसके कारण संयोजी कोश में उपस्थित इलेक्ट्रॉन नाभिक द्वारा दृढ़ता से बंधे नहीं रहते है | इस प्रकार बाह्रातम कोश तथा नाभिक के बीच उपस्थित इलेक्ट्रॉन द्वारा नाभिकीय आकर्षण में डाले गये बाधा को परिरक्षण प्रभाव कहते हैं, जिसके कारण बाहरी कोश का इलेक्ट्रॉन ढीला बँधा रहता है |
प्रश्न 8 : N की आयनन की एन्थैल्पी O से ज्यादा होती है। क्यों ?
उत्तर: N में अर्धपूर्ण भरे p[p3]कक्षकों के अधिक स्थायी होने के कारण N में से निकालने के लिये अधिक ऊर्जा की आवश्यकता होगी अत: N की आयनन ऐन्थैल्पी का मान Oxygen से अधिक है।
3 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर: किसी परमाणु में परमाणु के नाभिक से बाह्रातम कोश तक की दूरी परमाणु त्रिज्या कहलाती है |
आवर्त - किसी आवर्त में बाये से दायें जाने पर कोशों की संख्या तो समान रहती है लेकिन परमाणु क्रमांक में वृद्धि के साथ बाहरी कोश में उपस्थित इलेक्ट्रॉन की संख्या में वृद्धि होती है तथा प्रभावी नाभिकीय आवेश भी बढ़ जाता है | इस प्रकार नाभिकीय आवेश के बढ़ने से नाभिक तथा बाहरी कोश के बीच आकर्षण बल बढ़ने के कारण त्रिज्या में कमी आती है अतः आवर्त में बायें से दायें जाने पर परमाणु त्रिज्या में कमी आती है |
वर्ग में - किसी वर्ग में ऊपर से नीचे जाने पर परमाणु के आकार में वृद्धि होती है , क्योकि इलेक्ट्रॉन नये कोश में प्रवेश करता है तथा कोशों की संख्या में भी वृद्धि होती है तथा नाभिकीय आवेश भी बढ़ता है | लेकिन नये कोश का प्रभाव नाभिक की आकर्षण से अधिक होता है |
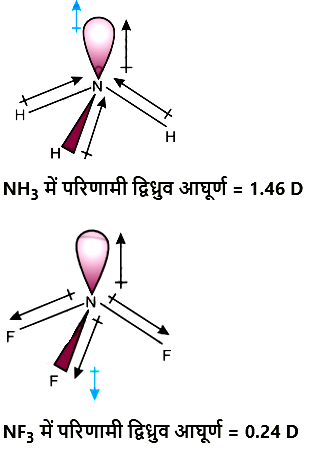
प्रश्न 2 : NH3 तथा NF3 में किस अणु का द्विध्रुव-आघूर्ण अधिक है और क्यों?
उत्तर: NH3 तथा NF3, दोनों अणुओं की पिरामिडी आकृति होती है तथा दोनों NH3 (3.0 − 2.1 = 0.9) तथा NF3 (4.0 − 3.0 = 1.0) अणुओं में विद्युत-ऋणात्मकता अंतर भी लगभग समान होता है, परंतु NH3 का द्विध्रुव आघूर्ण (1.46 D), NF3 (0.24 D) की तुलना में अधिक होता है। इसकी व्याख्या द्विध्रुव आघूर्णो की दिशा में अंतर के आधार पर की जा सकती है।
NH3 में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन-युग्म का कक्षक द्विध्रुव आघूर्ण तीन N–F आबंधों के द्विध्रुव आघूर्णों के परिणामी द्विध्रुव आघूर्ण की विपरीत दिशा में होता है। कक्षक द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन-युग्म के कारण N–F आबंध-आघूर्णों के परिणामी द्विध्रुव आघूर्ण के प्रभाव को कम करता है। इसके फलस्वरूप NF3 के अणु का द्विध्रुव आघूर्ण कम होता है।
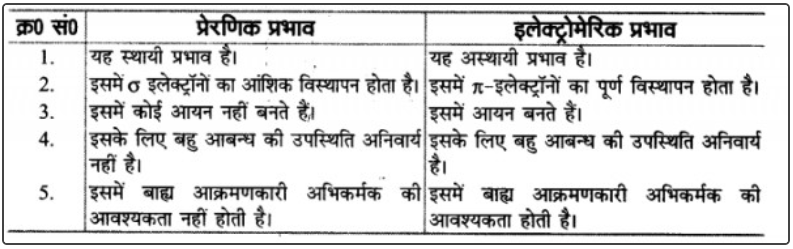
प्रश्न 3 : प्रेरणिक प्रभाव और इलेक्ट्रोमेरिक प्रभाव में अंतर लिखिए।
उत्तर:
प्रश्न 4 : एक ही वर्ग में उपस्थित तत्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
उत्तर: एक ही वर्ग में उपस्थित तत्वों के इलेक्ट्रॉनिक विन्यास समान प्रकार के होते है अर्थात उनकी संयोजी कक्षा में एलेक्ट्रोनो की संख्या समान होती है । इसी कारण से एक वर्ग में उपस्थित तत्वों के भौतिक तथा रासायनिक गुणधर्म समान होते है ।
4 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : प्रेरणिक प्रभाव समझाइए। इसके कोई तीन अनुप्रयोग लिखिए।
उत्तर: भिन्न विद्युत-ऋणात्मकता के दो परमाणुओं के मध्य निर्मित सहसंयोजक आबंध में इलेक्ट्रॉन असमान रूप से सहभाजित होते हैं। इलेक्ट्रॉन घनत्व उच्च विद्युत ऋणात्मकता के परमाणु के ओर अधिक होता है। इस कारण सहसंयोजक आबंध ध्रुवीय हो जाता है।
अनुप्रयोग
1. द्विध्रुव आघूर्ण : अणु में –I प्रेरणिक प्रभाव बढ़ने के साथ साथ द्विध्रुव आघूर्ण भी बढ़ता जाता है |
2. एल्कोहल की अम्लीय प्रवृत्ति : I प्रभाव बढ़ने से एल्कोहल की अम्लीय प्रवृति बढती है जबकि +I प्रभाव उसके विपरीत अम्लीय प्रवृत्ति को घटता है |
3. -I प्रभाव क्षारीय प्रबलता को घटा देता है |
| MP Board Class 11 Study Material | |
| MP Board Class 11 Books | MP Board Class 11 Previous Year Questions Paper |
प्रश्न 2 : इलेक्ट्रोमेरिक प्रभाव क्या है +E और –E प्रभाव स्पष्ट कीजिए।
उत्तर:
इलेक्ट्रोमेरिक प्रभाव:
- इलेक्ट्रोमेरिक प्रभाव एक अस्थायी प्रभाव है जो असंतृप्त यौगिकों में केवल पास के अभिकर्मक की मांग पर काम करता है।
- इसमें का पूरा स्थानांतरण शामिल हैπ
- एकाधिक बंधों के इलेक्ट्रॉन।
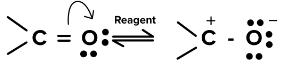
- न्यूक्लियोफाइल द्वारा कार्बोनिल समूह के हमले के दौरानπ-इलेक्ट्रॉन जोड़ी-कार्बन और ऑक्सीजन को पूरी तरह से ऑक्सीजन में स्थानांतरित कर देती है, अर्थात,
यहां कार्बोनिल समूह की उपरोक्त-ध्रुवीकृत संरचना में सकारात्मक रूप से चार्ज किया गया कार्बन न्यूक्लियोफिलिक अभिकर्मक द्वारा हमले का केंद्र है।
+E प्रभाव:
- जब का स्थानांतरणπ इलेक्ट्रॉन परमाणु की ओर बढ़ते हैं जहां हमलावर अभिकर्मक (इलेक्ट्रोफाइल) अंततः जुड़ जाता है, इस प्रभाव को +ई प्रभाव कहा जाता है।
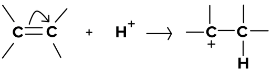
- +E प्रभाव का उदाहरण है
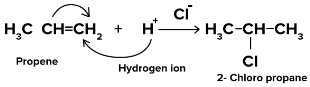
- यहां दोहरा बंधन टूटता है और स्थानांतरण होता हैπ इलेक्ट्रॉन हाइड्रोजन आयन की ओर बढ़ते हैं
-E प्रभाव
- जब का स्थानांतरणπ इलेक्ट्रॉन हमलावर अभिकर्मक ('न्यूक्लियोफाइल) से दूर होते हैं, इस प्रभाव को -ई प्रभाव कहा जाता है।
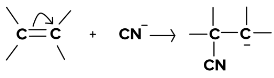
- -E प्रभाव का उदाहरण है
- यहां दोहरा बंधन टूटता है और स्थानांतरण होता हैπ इलेक्ट्रॉन सायनाइड आयन से दूर होते हैं।
प्रश्न 3 : इलेक्ट्रॉनस्नेही तथा नाभिकस्नेही क्या है? उदाहरण सहित समझाइए।
उत्तर:

MP Board VVI 5 अंकीय महत्वपूर्ण प्रश्न
प्रश्न 1 : निम्न को समझाइये –
(1) हुण्ड का अधिकतम बहुलता का नियम
(2) पाउली का अपवर्जन सिद्धान्त
उत्तर:
(1) हुण्ड का अधिकतम बहुलता का नियम
किसी उपकोश के कक्षको में इलेक्ट्रॉनों का वितरण हुंड के अधिकतम बहुलता नियम (hund principle in Hindi) के अनुसार होता है।
इस नियम के अनुसार, किसी उपकोश के कक्षको में इलेक्ट्रॉनों का युग्मन तभी होता है। जब उस उपकोश के सभी कक्षको में एक-एक इलेक्ट्रॉन भर जाता है।
अतः इस नियम के अनुसार, s-कक्षक में दूसरे इलेक्ट्रॉन के भरने पर युग्मन आरंभ होता है। इसी प्रकार की p-कक्षक में चौथे इलेक्ट्रॉन के प्रवेश पर युग्मन प्रारंभ होता है। तथा d-कक्षक में छठे इलेक्ट्रॉन के भरने पर युग्मन प्रारंभ होता है। एवं f-कक्षक में आठवें इलेक्ट्रॉन के भरने पर युग्मन प्रारंभ होता है। किसी उपकोश के कक्षको में इलेक्ट्रॉनों की व्यवस्था को आयताकार आरेखों द्वारा दर्शाते हैं।
(2) पाउली का अपवर्जन सिद्धान्त
पाउली का अपवर्जन का सिद्धांत : क्वाण्टम यांत्रिकी का एक नियम है|
इस सिद्धान्त के अनुसार :-
"कोई भी दो समान फर्मिऑन, एक ही समय में, एक समान प्रमात्रा(quantum) स्थिति में नहीं रह सकते। "
किसी एक ही परमाणु में स्थित इलेक्ट्रॉनों के लिये यह नियम कहता है कि "किन्ही भी दो इलेक्ट्रॉनों की चारों (यानी सभी) प्रमात्रा संख्याएं एक समान नहीं हो सकतीं।
इस सिद्धान्त के अनुसार समान अवस्था वाले अथवा समान गुणधर्म वाले दो कण (जिनके प्रचक्रण, कलर चार्ज, कोणीय संवेग इत्यदि समान हो) किसी एक समय मे किसी एक स्थान पर नहीं रह सकते है।
जो कण इस सिध्दांत का पालन करते है, फर्मिऑन कहलाते है एवं जो कण इस सिध्दांत का पालन नहीं करते है, बोसॉन कहलाते है ।
प्रश्न 2 : हाइजेनबर्ग का अनिश्चिता सिद्धान्त क्या है? इसका गणितीय रूप लिखिए।
उत्तर: हाइजेनबर्ग का अनिश्चितता का सिद्धांत
द्रव्य और विकिरण के दोहरे व्यवहार के फलस्वरुप भौतिक वैज्ञानिक वर्नर हाइजेनबर्ग ने सन् 1927 में एक सिद्धांत प्रस्तुत किया जिसे हाइजेनबर्ग का अनिश्चितता का सिद्धांत (Heisenberg uncertainty principle in Hindi) कहते हैं।
इस सिद्धांत के अनुसार, किसी गतिशील अति सूक्ष्म कण (इलेक्ट्रॉन) की सही स्थिति और सही वेग का निर्धारण एक साथ करना असंभव है।
हाइजेनबर्ग अनिश्चितता सिद्धांत का गणितीय रूप
उपरोक्त परिभाषा के अनुसार अनिश्चितता सिद्धांत को गणितीय रूप में निम्न प्रकार लिखा जा सकता है।
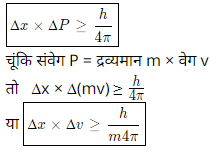
जहां ∆x = कण की स्थिति में अनिश्चितता
∆P = संवेग में अनिश्चितता
h = प्लांक नियतांक है।
इस सूत्र द्वारा स्पष्ट होता है कि किसी गतिशील अति सूक्ष्म कण के संवेग में अनिश्चितता (∆P) और कण की स्थिति में अनिश्चितता (∆x) का गुणनफल या तो h/4π के बराबर होगा या उससे अधिक होगा।
अर्थात् इस प्रकार ज्ञात होता है कि यदि किसी इलेक्ट्रॉन की सही स्थिति ज्ञात है तो उसके वेग में अनिश्चितता अधिक होगी। ठीक इसी प्रकार यदि किसी इलेक्ट्रॉन का वेग बिल्कुल ठीक ज्ञात है तो उसकी स्थिति में अनिश्चितता होगी।
अतः इस प्रकार स्पष्ट होता है कि अनिश्चितता के सिद्धांत का महत्व केवल अति सूक्ष्म कणों (जैसे इलेक्ट्रॉन) के लिए ही लागू होता है। बड़े कणों के लिए इसका मान लगभग शून्य होता है। उन पर यह सिद्धांत लागू नहीं होता है।
प्रश्न 3 : पदार्थ की द्वैती प्रकृति क्या है? इससे सम्बन्धित डी –ब्रोग्ली समीकरण लिखिए।
उत्तर: पदार्थ की द्वैती प्रकृति के अनुसार, “पदार्थ के छोटे से छोटे कण जैसे इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन जब गति में होते हैं तो उनकी प्रकृति कण जैसी होने के साथ-साथ तरंग जैसी भी होती है अर्थात् इलेक्ट्रॉन भी प्रकाश की भाँति एक ही समय में कण तथा तरंग दोनों की तरह व्यवहार करता है।"
डी-ब्रोग्ली समीकरण : मैक्स प्लांक व आइन्सटीन के द्रव्यमान ऊर्जा संबंधी समीकरणों से ही डी ब्राउली समीकरण की व्यूत्पत्ति होती है।
माना किसी तरंग के कण का द्रव्यमान m तथा उसका वेग c है
तब द्रव्यमान कण के लिए आइन्सटीन समीकरण
E = mc2 ..... (i)
व प्लांक अनुसार द्रव्य कण की ऊर्जा
E = hv ..(ii) [h = प्लांक नियतांक ]
समी 1 तथा 2 से
mc2 = h v
mc2 = h ( c / λ ) ( v = c / λ )
mc=h / λ
λ = h / mc .. (iii) λ = h / mv { यदि c = v हो तो )
λ = h / p .. (iv) { जबकि mc = p )
p = h / λ
p ∝ 1 / λ
संवेग ∝ 1 / तरंगदैर्घ्य







 Profile
Profile Signout
Signout












 Quiz
Quiz
 Get latest Exam Updates
Get latest Exam Updates 










